Постоянная Больцмана, представляющая собой коэффициент, равный k = 1 , 38 · 10 - 23 Д ж К, является частью значительного числа формул в физике. Она получила свое название по имени австрийского физика – одного из основоположников молекулярно-кинетической теории. Сформулируем определение постоянной Больцмана:
Определение 1
Постоянной Больцмана называется физическая постоянная, с помощью которой определяется связь между энергией и температурой.
Не следует путать ее с постоянной Стефана-Больцмана, связанной с излучением энергии абсолютно твердого тела.
Существуют различные методы вычисления данного коэффициента. В рамках этой статьи мы рассмотрим два их них.
Нахождение постоянной Больцмана через уравнение идеального газа
Данная постоянная может быть найдена с помощью уравнения, описывающего состояние идеального газа. Опытным путем можно определить, что нагревание любого газа от T 0 = 273 К до T 1 = 373 К приводит к изменению его давления от p 0 = 1 , 013 · 10 5 П а до p 0 = 1 , 38 · 10 5 П а. Это достаточно простой эксперимент, который может быть проведен даже просто с воздухом. Для измерения температуры при этом нужно использовать термометр, а давления – манометр. При этом важно помнить, что количество молекул в моле любого газа примерно равно 6 · 10 23 , а объем при давлении в 1 а т м равен V = 22 , 4 л. С учетом всех названных параметров можно перейти к вычислению постоянной Больцмана k:
Для этого запишем уравнение дважды, подставив в него параметры состояний.
Зная результат, можем найти значение параметра k:
Нахождение постоянной Больцмана через формулу броуновского движения
Для второго способа вычисления нам также потребуется провести эксперимент. Для него нужно взять небольшое зеркало и подвесить в воздухе с помощью упругой нитки. Допустим, что система зеркало-воздух находится в стабильном состоянии (статическом равновесии). Молекулы воздуха ударяют в зеркало, которое, по сути, ведет себя как броуновская частица. Однако с учетом его подвешенного состояния мы можем наблюдать вращательные колебания вокруг определенной оси, совпадающей с подвесом (вертикально направленной нитью). Теперь направим на поверхность зеркала луч света. Даже при незначительных движениях и поворотах зеркала отражающийся в нем луч будет заметно смещаться. Это дает нам возможность измерить вращательные колебания объекта.
Обозначив модуль кручения как L , момент инерции зеркала по отношению к оси вращения как J , а угол поворота зеркала как φ , можем записать уравнение колебаний следующего вида:
Минус в уравнении связан с направлением момента сил упругости, который стремится вернуть зеркало в равновесное положение. Теперь произведем умножение обеих частей на φ , проинтегрируем результат и получим:
Следующее уравнение является законом сохранения энергии, который будет выполняться для данных колебаний (то есть потенциальная энергия будет переходить в кинетическую и обратно). Мы можем считать эти колебания гармоническими, следовательно:
При выведении одной из формул ранее мы использовали закон равномерного распределения энергии по степеням свободы. Значит, можем записать так:
Как мы уже говорили, угол поворота можно измерить. Так, если температура будет равна приблизительно 290 К, а модуль кручения L ≈ 10 - 15 Н · м; φ ≈ 4 · 10 - 6 , то рассчитать значение нужного нам коэффициента можно так:
Следовательно, зная основы броуновского движения, мы можем найти постоянную Больцмана с помощью измерения макропараметров.
Значение постоянной Больцмана
Значение изучаемого коэффициента состоит в том, что с его помощью можно связать параметры микромира с теми параметрами, что описывают макромир, например, термодинамическую температуру с энергией поступательного движения молекул:
Этот коэффициент входит в уравнения средней энергии молекулы, состояния идеального газа, кинетической теории газа, распределение Больцмана-Максвелла и многие другие. Также постоянная Больцмана необходима для того, чтобы определить энтропию. Она играет важную роль при изучении полупроводников, например, в уравнении, описывающем зависимость электропроводности от температуры.
Пример 1
Условие: вычислите среднюю энергию молекулы газа, состоящего из N -атомных молекул при температуре T , зная, что у молекул возбуждены все степени свободы – вращательные, поступательные, колебательные. Все молекулы считать объемными.
Решение
Энергия равномерно распределяется по степеням свободы на каждую ее степень, значит, на эти степени будет приходиться одинаковая кинетическая энергия. Она будет равна ε i = 1 2 k T . Тогда для вычисления средней энергии мы можем использовать формулу:
ε = i 2 k T , где i = m p o s t + m υ r + 2 m k o l представляет собой сумму поступательных вращательных степеней свободы. Буквой k обозначена постоянная Больцмана.
Переходим к определению количества степеней свободы молекулы:
m p o s t = 3 , m υ r = 3 , значит, m k o l = 3 N - 6 .
i = 6 + 6 N - 12 = 6 N - 6 ; ε = 6 N - 6 2 k T = 3 N - 3 k T .
Ответ: при данных условиях средняя энергия молекулы будет равна ε = 3 N - 3 k T .
Пример 2
Условие: есть смесь двух идеальных газов, плотность которых в нормальных условиях равна p. Определите, какова будет концентрация одного газа в смеси при условии, что мы знаем молярные массы обоих газов μ 1 , μ 2 .
Решение
Сначала вычислим общую массу смеси.
m = ρ V = N 1 m 01 + N 2 m 02 = n 1 V m 01 + n 2 V m 02 → ρ = n 1 m 01 + n 2 m 02 .
Параметр m 01 обозначает массу молекулы одного газа, m 02 – массу молекулы другого, n 2 – концентрацию молекул одного газа, n 2 – концентрацию второго. Плотность смеси равна ρ .
Теперь из данного уравнения выразим концентрацию первого газа:
n 1 = ρ - n 2 m 02 m 01 ; n 2 = n - n 1 → n 1 = ρ - (n - n 1) m 02 m 01 → n 1 = ρ - n m 02 + n 1 m 02 m 01 → n 1 m 01 - n 1 m 02 = ρ - n m 02 → n 1 (m 01 - m 02) = ρ - n m 02 .
p = n k T → n = p k T .
Подставим полученное равнее значение:
n 1 (m 01 - m 02) = ρ - p k T m 02 → n 1 = ρ - p k T m 02 (m 01 - m 02) .
Поскольку молярные массы газов нам известны, мы можем найти массы молекул первого и второго газа:
m 01 = μ 1 N A , m 02 = μ 2 N A .
Также мы знаем, что смесь газов находится в нормальных условиях, т.е. давление равно 1 а т м, а температура 290 К. Значит, мы можем считать задачу решенной.
Если вы заметили ошибку в тексте, пожалуйста, выделите её и нажмите Ctrl+Enter
Согласно закону Стефана – Больцмана плотность интегрального полусферического излучения E 0 зависит только от температуры и изменяется пропорционально четвертой степени абсолютной температуры T :
Стефана – Больцмана постоянная σ 0 – физическая постоянная, входящая в закон, определяющий объемную плотность равновесного теплового излучения абсолютно черного тела:

Исторически закон Стефана-Больцмана был сформулирован раньше закона излучения Планка, из которого он вытекает как следствие. Закон Планка устанавливает зависимость спектральной плотности потока излучения E 0 от длины волны λ и температуры T :

где λ – длина волны, м; с
=2,998 10 8 м/с – скорость
света в вакууме; Т
– температура тела, К;
h
= 6,625 ×10 -34 Дж×с– постоянная Планка.
Физическая постоянная k , равная отношению универсальной газовой постоянной R =8314Дж/(кг× K) к числу Авогадро NA =6,022× 10 26 1/(кг× моль):
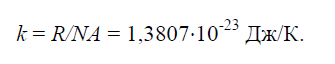
Число различных конфигураций системы из N частиц для данного набора чисел n i (число частиц, находящихся в i -том состоянии, которому соответствует энергия e i ) пропорционально величине:

Величина W есть число способов распределения N частиц по энергетическим уровням. Если справедливо соотношение (6) то считается, что исходная система подчиняется статистике Больцмана. Набор чисел n i , при котором число W максимально, встречается наиболее часто и соответствует наиболее вероятному распределению.
Физическая кинетика – микроскопическая теория процессов в статистически неравновесных системах.
Описание большого числа частиц может успешно осуществляться вероятностными методами. Для одноатомного газа состояние совокупности молекул определяется их координатами и значениями проекций скоростей на соответствующие координатные оси. Математически это описывается функцией распределения, характеризующей вероятность пребывания частицы в данном состоянии:

есть ожидаемое число молекул в объеме d d , координаты которых находятся в интервале от до +d , а скорости в интервале от до +d.
Если осредненной по времени потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией, то газ называется идеальным. Идеальный газ называется газом Больцмана, если отношение длины пробега молекул в этом газе к характерному размеру течения L конечно, т.е.

т.к. длина пробега обратно пропорциональна nd 2 (n – числовая плотность 1/м 3 , d – диаметр молекулы, м).
Величину
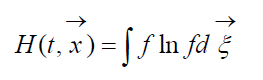
называют H -функцией Больцмана для единицы объема, которая связана с вероятностью обнаружения системы из молекул газа в данном состоянии. Каждому состоянию соответствуют определенные числа заполнения шестимерных пространственно-скоростных ячеек, на которые может быть разбито фазовое пространство рассматриваемых молекул. Обозначим W вероятность того, что в первой ячейке рассматриваемого пространства окажется N 1 молекул, во второй N 2 и т.д.
С точностью до постоянной, определяющей начало отсчета вероятности, правомерно соотношение:
 ,
,
где  – H-функция области
пространства А
, занятой газом. Из (9) видно, что W
и H
взаимосвязаны, т.е. изменение вероятности состояния приводит к соответствующей
эволюции H функции.
– H-функция области
пространства А
, занятой газом. Из (9) видно, что W
и H
взаимосвязаны, т.е. изменение вероятности состояния приводит к соответствующей
эволюции H функции.

Больцмана принцип устанавливает связь между энтропией S физической системы и термодинамической вероятностью W её состояния:

(печатается по изданию: Коган М.Н. Динамика разреженного газа. – М.: Наука, 1967.)
Общий вид КУБ:

где – массовая сила, обусловленная наличием различных полей (гравитационного, электрического, магнитного), действующая на молекулу; J – интеграл столкновений. Именно этот член уравнения Больцмана учитывает столкновения молекул друг с другом и соответствующие изменения скоростей взаимодействующих частиц. Интеграл столкновений представляет собой пятимерный интеграл и имеет следующую структуру:

Уравнение (12) с интегралом (13) получено для столкновения молекул, при которых не возникает тангенциальных сил, т.е. сталкивающиеся частицы считаются идеально гладкими.
В процессе
взаимодействия внутренняя энергия молекул не меняется, т.е. предполагается, что
эти молекулы являются идеально упругими. Рассматриваются две группы молекул,
имеющих до соударения друг с другом (столкновения) скорости и (рис. 1), а после
столкновения соответственно скорости и . Разность скоростей и называется
относительной скоростью, т.е. . Ясно, что для гладкого упругого
столкновения .
Функции распределения f 1 ", f", f 1 ,f
описывают
молекулы соответствующих групп после и до столкновений, т.е. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Рис. 1. Столкновение двух молекул.
В (13) входят два параметра, характеризующие расположение сталкивающихся молекул друг относительно друга: b и ε; b – прицельное расстояние, т.е. наименьшее расстояние, на которое сблизились бы молекулы при отсутствии взаимодействия (рис. 2); ε называют угловым параметром столкновений (рис. 3). Интегрирование по b от 0 до ¥ и по от 0 до 2p (два внешних интеграла в (12)) охватывает всю плоскость силового взаимодействия перпендикулярно вектору

Рис. 2. Траектория движения молекул.

Рис. 3. Рассмотрение взаимодействия молекул в цилиндрической системе координат: z , b , ε
Кинетическое уравнение Больцмана выведено при следующих допущениях и предположениях.
1. Считается, что происходит в основном столкновения двух молекул, т.е. роль столкновений одновременно трех и большего числа молекул незначительна. Это допущение позволяет использовать для анализа одночастичную функцию распределения, которая выше названа просто функцией распределения. Учет столкновения трех молекул приводит к необходимости использования в исследовании двухчастичной функции распределения. Соответственно анализ существенно усложняется.
2. Предположение о молекулярном хаосе. Оно выражается в том, что вероятности обнаружения частицы 1 в фазовой точке и частицы 2 в фазовой точке независимы друг от друга.
3.
Равновероятны столкновения молекул с любым прицельным расстоянием, т.е. функция
распределения не меняется на диаметре взаимодействия. Необходимо отметить, что
анализируемый элемент должен быть малым, чтобы f
в пределах этого элемента не менялась, но в то же время
чтобы
не была велика относительная флуктуация ~
. Потенциалы
взаимодействия, используемые при вычислении интеграла столкновений, являются
сферически симметричными, т.е. ![]() .
.
Распределение Максвелла-Больцмана
Равновесное состояние газа описывается абсолютным Максвелловским распределением, которое является точным решением кинетического уравнения Больцмана:

где m – масса молекулы, кг.
Общее локально-максвелловское распределение иначе называемое распределение Максвелла-Больцмана:

в том случае, когда газ движется
как целое со скоростью и переменные n
,
T
зависят от координаты
и времени t
.
В поле тяготения Земли точное решение уравнения Больцмана показывает:

где n 0 = плотность у поверхности Земли, 1/м 3 ; g – ускорение силы тяжести, м/с 2 ; h – высота, м. Формула (16) является точным решением кинетического уравнения Больцман либо в безграничном пространстве, либо при наличии границ, не нарушающих этого распределения, при этом температура также должна оставаться постоянной.
Эта страница оформлена Пузиной Ю.Ю. при поддержке Российского Фонда Фундаментальных Исследований – проект №08-08-00638.
Постоянная Больцмана перекидывает мост из макромира в микромир, связывая температуру с кинетической энергией молекул.
Людвиг Больцман — один из создателей молекулярно-кинетической теории газов, на которой зиждется современная картина взаимосвязи между движением атомов и молекул с одной стороны и макроскопическими свойствами материи, такими как температура и давление, с другой. В рамках такой картины давление газа обусловлено упругими ударами молекул газа о стенки сосуда, а температура — скоростью движения молекул (а точнее, их кинетической энергией).Чем быстрее движутся молекулы, тем выше температура.
Постоянная Больцмана дает возможность напрямую связать характеристики микромира с характеристиками макромира — в частности, с показаниями термометра. Вот ключевая формула, устанавливающая это соотношение:
1/2 mv 2 = kT
где m и v — соответственно масса и средняя скорость движения молекул газа, Т — температура газа (по абсолютной шкале Кельвина), а k — постоянная Больцмана. Это уравнение прокладывает мостик между двумя мирами, связывая характеристики атомного уровня (в левой части) с объемными свойствами (в правой части), которые можно измерить при помощи человеческих приборов, в данном случае термометров. Эту связь обеспечивает постоянная Больцмана k , равная 1,38 x 10 -23 Дж/К.
Раздел физики, изучающий связи между явлениями микромира и макромира, называется статистическая механика. В этом разделе едва ли найдется уравнение или формула, в которых не фигурировала бы постоянная Больцмана. Одно из таких соотношений было выведено самим австрийцем, и называется оно просто уравнение Больцмана :
S = k log p + b
где S — энтропия системы (см. Второе начало термодинамики), p — так называемый статистический вес (очень важный элемент статистического подхода), а b — еще одна константа.
Всю жизнь Людвиг Больцман в буквальном смысле опережал свое время, разрабатывая основы современной атомной теории строения материи, вступая в яростные споры с подавляющим консервативным большинством современного ему научного сообщества, считавшего атомы лишь условностью, удобной для расчетов, но не объектами реального мира. Когда его статистический подход не встретил ни малейшего понимания даже после появления специальной теории относительности, Больцман в минуту глубокой депрессии покончил с собой. Уравнение Больцмана высечено на его надгробном памятнике.
Boltzmann, 1844-1906
Австрийский физик. Родился в Вене в семье госслужащего. Учился в Венском университете на одном курсе с Йозефом Стефаном (см. Закон Стефана—Больцмана). Защитившись в 1866 году, продолжил научную карьеру, занимая в разное время профессорские должности на кафедрах физики и математики университетов Граца, Вены, Мюнхена и Лейпцига. Будучи одним из главных сторонников реальности существования атомов, сделал ряд выдающихся теоретических открытий, проливающих свет на то, каким образом явления на атомном уровне сказываются на физических свойствах и поведении материи.
Для постоянной, связанной с энергией излучения чёрного тела, смотри Постоянная Стефана-Больцмана
|
Значение постоянной k |
Размерность |
|
1,380 6504(24) 10 −23 |
|
|
8,617 343(15) 10 −5 |
|
|
1,3807 10 −16 |
|
|
Смотри также Значения в различных единицах ниже. |
|
Постоянная Больцмана (k или k B ) - физическая постоянная, определяющая связь между температурой вещества и энергией теплового движения частиц этого вещества. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в системе СИ равно
В таблице последние цифры в круглых скобках указывают стандартную погрешность значения постоянной. В принципе, постоянная Больцмана может быть получена из определения абсолютной температуры и других физических постоянных. Однако точное вычисление постоянной Больцмана с помощью основных принципов слишком сложно и невыполнимо при современном уровне знаний.
Экспериментально постоянную Больцмана можно определить с помощью закона теплового излучения Планка, описывающего распределение энергии в спектре равновесного излучения при определённой температуре излучающего тела, а также другими методами.
Существует связь между универсальной газовой постоянной и числом Авогадро , из которой следует значение постоянной Больцмана:
Размерность постоянной Больцмана такая же, как и у энтропии.
|
История
В 1877 г. Больцман впервые связал между собой энтропию и вероятность, однако достаточно точное значение постоянной k как коэффициента связи в формуле для энтропии появилось лишь в трудах М. Планка. При выводе закона излучения чёрного тела Планк в 1900–1901 гг. для постоянной Больцмана нашёл значение 1,346 10 −23 Дж/K, почти на 2,5% меньше принятого в настоящее время.
До 1900 г. соотношения, которые сейчас записываются с постоянной Больцмана, писались с помощью газовой постоянной R , а вместо средней энергии на одну молекулу использовалась общая энергия вещества. Лаконичная формула вида S = k log W на бюсте Больцмана стала таковой благодаря Планку. В своей нобелевской лекции в 1920 г. Планк писал:
Эта константа часто называется постоянной Больцмана, хотя, насколько я знаю, сам Больцман никогда не вводил её - странное состояние дел, при том, что в высказываниях Больцмана не было речи о точном измерении этой константы.
Такая ситуация может быть объяснена проведением в то время научных дебатов по выяснению сущности атомного строения вещества. Во второй половине 19 века существовали значительные разногласия в отношении того, являются ли атомы и молекулы реальными, либо они лишь удобный способ описания явлений. Не было единства и в том, являются ли "химические молекулы", различаемые по их атомной массе, теми же самыми молекулами, что и в кинетической теории. Далее в нобелевской лекции Планка можно найти следующее:
«Ничто не может лучше продемонстрировать положительную и ускоряющуюся скорость прогресса, чем искусство эксперимента за последние двадцать лет, когда было открыто сразу множество методов измерения массы молекул практически с той же точностью, что и измерение массы какой-нибудь планеты».
Уравнение состояния идеального газа
Для идеального газа справедлив объединённый газовый закон, связывающий давление P , объём V , количество вещества n в молях, газовую постоянную R и абсолютную температуру T :
В данном равенстве можно сделать замену . Тогда газовый закон будет выражаться через постоянную Больцмана и количество молекул N в объёме газа V :
Связь между температурой и энергией
В однородном идеальном газе, находящемся при абсолютной температуре T
, энергия, приходящаяся на каждую поступательную
степень свободы, равна, как следует из распределения Максвелла, kT
/ 2
. При комнатной температуре
(≈ 300 K) эта энергия составляет ![]() Дж,
или 0,013 эВ.
Дж,
или 0,013 эВ.
Соотношения газовой термодинамики
В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия 3kT / 2 . Это хорошо согласуется с экспериментальными данными. Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню из атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона.
Кинетическая теория даёт формулу для среднего давления P идеального газа:
![]()
Учитывая, что средняя кинетическая энергия прямолинейного движения равна:
![]()
находим уравнение состояния идеального газа:
Это соотношение неплохо выполняется и для молекулярных газов; однако зависимость теплоёмкости изменяется, так как молекулы могут иметь дополнительные внутренние степени свободы по отношению к тем степеням свободы, которые связаны с движением молекул в пространстве. Например, двухатомный газ имеет уже приблизительно пять степеней свободы.
Множитель Больцмана
В общем случае система в равновесии с тепловым резервуаром при температуре T имеет вероятность p занять состояние с энергией E , что может быть записано с помощью соответствующего экспоненциального множителя Больцмана:
![]()
В данном выражении фигурирует величина kT с размерностью энергии.
Вычисление вероятности используется не только для расчётов в кинетической теории идеальных газов, но и в других областях, например в химической кинетике в уравнении Аррениуса.
Роль в статистическом определении энтропии
Основная статья : Термодинамическая энтропия
Энтропия S изолированной термодинамической системы в термодинамическом равновесии определяется через натуральный логарифм от числа различных микросостояний W , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией E ):
![]()
Коэффициент пропорциональности k является постоянной Больцмана. Это выражение, определяющее связь между микроскопическими и макроскопическими состояниями (через W и энтропию S соответственно), выражает центральную идею статистической механики и является главным открытием Больцмана.
В классической термодинамике используется выражение Клаузиуса для энтропии:
![]()
Таким образом, появление постоянной Больцманаk можно рассматривать как следствие связи между термодинамическим и статистическим определениями энтропии.
Энтропию можно выразить в единицах k , что даёт следующее:
В таких единицах энтропия точно соответствует информационной энтропии.
Характерная энергия kT равна количеству теплоты, необходимому для увеличения энтропии S " на один нат.
Роль в физике полупроводников: тепловое напряжение
В отличие от других веществ, в полупроводниках существует сильная зависимость электропроводности от температуры:
где множитель σ 0 достаточно слабо зависит от температуры по сравнению с экспонентой, E A – энергия активации проводимости. Плотность электронов проводимости также экспоненциально зависит от температуры. Для тока через полупроводниковый p-n-переход вместо энергии активации рассматривают характерную энергию данного p-n перехода при температуре T как характерную энергию электрона в электрическом поле:
где q – , а V T есть тепловое напряжение, зависящее от температуры.
Данное соотношение является основой для выражения постоянной Больцмана в единицах эВ∙К −1 . При комнатной температуре (≈ 300 K) значение теплового напряжения порядка 25,85 милливольт ≈ 26 мВ.
В классической теории часто используют формулу, согласно которой эффективная скорость носителей заряда в веществе равна произведению подвижности носителей μ на напряженность электрического поля. В другой формуле плотность потока носителей связывается с коэффициентом диффузии D и с градиентом концентрации носителей n :
![]()
Согласно соотношению Эйнштейна-Смолуховского, коэффициент диффузии связан с подвижностью:
![]()
Постоянная Больцмана k входит также в закон Видемана-Франца, по которому отношение коэффициента теплопроводности к коэффициенту электропроводности в металлах пропорционально температуре и квадрату отношения постоянной Больцмана к электрическому заряду.
Применения в других областях
Для разграничения температурных областей, в которых поведение вещества описывается квантовыми или классическими методами, служит температура Дебая:
![]()
где – , ![]() есть предельная частота упругих
колебаний кристаллической решётки, u
–
скорость звука в твёрдом теле, n
–
концентрация атомов.
есть предельная частота упругих
колебаний кристаллической решётки, u
–
скорость звука в твёрдом теле, n
–
концентрация атомов.
Постоя́нная Бо́льцмана ( или ) - физическая постоянная , определяющая связь между температурой и энергией . Названа в честь австрийского физика Людвига Больцмана , сделавшего большой вклад в статистическую физику , в которой эта постоянная играет ключевую роль. Её экспериментальное значение в Международной системе единиц (СИ) равно:
Дж / .
Числа в круглых скобках указывают стандартную погрешность в последних цифрах значения величины. В естественной системе единиц Планка естественная единица температуры задаётся так, что постоянная Больцмана равна единице.
Связь между температурой и энергией
В однородном идеальном газе , находящемся при абсолютной температуре , энергия, приходящаяся на каждую поступательную степень свободы , равна, как следует из распределения Максвелла , . При комнатной температуре (300 ) эта энергия составляет Дж , или 0,013 эВ . В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в .
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона . В случае молекулярного газа ситуация усложняется, например, двухатомный газ имеет пять степеней свободы (при низких температурах, когда не возбуждены колебания атомов в молекуле).
Определение энтропии
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
Коэффициент пропорциональности и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими () и макроскопическими состояниями (), выражает центральную идею статистической механики.
Предполагаемая фиксация значения
XXIV Генеральная конференция по мерам и весам , состоявшаяся 17-21 октября 2011 года, приняла резолюцию , в которой, в частности, предложено будущую ревизию Международной системы единиц произвести так, чтобы зафиксировать значение постоянной Больцмана, после чего она будет считаться определённой точно . В результате будет выполняться точное равенство k =1,380 6X·10 −23 Дж/К . Такая предполагаемая фиксация связана со стремлением переопределить единицу термодинамической температуры кельвин , связав его величину со значением постоянной Больцмана.
См. также
Напишите отзыв о статье "Постоянная Больцмана"
Примечания
| Это заготовка статьи по термодинамике и статистической физике . Вы можете помочь проекту, дополнив её. |
Отрывок, характеризующий Постоянная Больцмана
– Но что же это значит? – задумчиво сказала Наташа.– Ах, я не знаю, как все это необычайно! – сказала Соня, хватаясь за голову.
Через несколько минут князь Андрей позвонил, и Наташа вошла к нему; а Соня, испытывая редко испытанное ею волнение и умиление, осталась у окна, обдумывая всю необычайность случившегося.
В этот день был случай отправить письма в армию, и графиня писала письмо сыну.
– Соня, – сказала графиня, поднимая голову от письма, когда племянница проходила мимо нее. – Соня, ты не напишешь Николеньке? – сказала графиня тихим, дрогнувшим голосом, и во взгляде ее усталых, смотревших через очки глаз Соня прочла все, что разумела графиня этими словами. В этом взгляде выражались и мольба, и страх отказа, и стыд за то, что надо было просить, и готовность на непримиримую ненависть в случае отказа.
Соня подошла к графине и, став на колени, поцеловала ее руку.
– Я напишу, maman, – сказала она.
Соня была размягчена, взволнована и умилена всем тем, что происходило в этот день, в особенности тем таинственным совершением гаданья, которое она сейчас видела. Теперь, когда она знала, что по случаю возобновления отношений Наташи с князем Андреем Николай не мог жениться на княжне Марье, она с радостью почувствовала возвращение того настроения самопожертвования, в котором она любила и привыкла жить. И со слезами на глазах и с радостью сознания совершения великодушного поступка она, несколько раз прерываясь от слез, которые отуманивали ее бархатные черные глаза, написала то трогательное письмо, получение которого так поразило Николая.
На гауптвахте, куда был отведен Пьер, офицер и солдаты, взявшие его, обращались с ним враждебно, но вместе с тем и уважительно. Еще чувствовалось в их отношении к нему и сомнение о том, кто он такой (не очень ли важный человек), и враждебность вследствие еще свежей их личной борьбы с ним.
Но когда, в утро другого дня, пришла смена, то Пьер почувствовал, что для нового караула – для офицеров и солдат – он уже не имел того смысла, который имел для тех, которые его взяли. И действительно, в этом большом, толстом человеке в мужицком кафтане караульные другого дня уже не видели того живого человека, который так отчаянно дрался с мародером и с конвойными солдатами и сказал торжественную фразу о спасении ребенка, а видели только семнадцатого из содержащихся зачем то, по приказанию высшего начальства, взятых русских. Ежели и было что нибудь особенное в Пьере, то только его неробкий, сосредоточенно задумчивый вид и французский язык, на котором он, удивительно для французов, хорошо изъяснялся. Несмотря на то, в тот же день Пьера соединили с другими взятыми подозрительными, так как отдельная комната, которую он занимал, понадобилась офицеру.
Все русские, содержавшиеся с Пьером, были люди самого низкого звания. И все они, узнав в Пьере барина, чуждались его, тем более что он говорил по французски. Пьер с грустью слышал над собою насмешки.
На другой день вечером Пьер узнал, что все эти содержащиеся (и, вероятно, он в том же числе) должны были быть судимы за поджигательство. На третий день Пьера водили с другими в какой то дом, где сидели французский генерал с белыми усами, два полковника и другие французы с шарфами на руках. Пьеру, наравне с другими, делали с той, мнимо превышающею человеческие слабости, точностью и определительностью, с которой обыкновенно обращаются с подсудимыми, вопросы о том, кто он? где он был? с какою целью? и т. п.
Вопросы эти, оставляя в стороне сущность жизненного дела и исключая возможность раскрытия этой сущности, как и все вопросы, делаемые на судах, имели целью только подставление того желобка, по которому судящие желали, чтобы потекли ответы подсудимого и привели его к желаемой цели, то есть к обвинению. Как только он начинал говорить что нибудь такое, что не удовлетворяло цели обвинения, так принимали желобок, и вода могла течь куда ей угодно. Кроме того, Пьер испытал то же, что во всех судах испытывает подсудимый: недоумение, для чего делали ему все эти вопросы. Ему чувствовалось, что только из снисходительности или как бы из учтивости употреблялась эта уловка подставляемого желобка. Он знал, что находился во власти этих людей, что только власть привела его сюда, что только власть давала им право требовать ответы на вопросы, что единственная цель этого собрания состояла в том, чтоб обвинить его. И поэтому, так как была власть и было желание обвинить, то не нужно было и уловки вопросов и суда. Очевидно было, что все ответы должны были привести к виновности. На вопрос, что он делал, когда его взяли, Пьер отвечал с некоторою трагичностью, что он нес к родителям ребенка, qu"il avait sauve des flammes [которого он спас из пламени]. – Для чего он дрался с мародером? Пьер отвечал, что он защищал женщину, что защита оскорбляемой женщины есть обязанность каждого человека, что… Его остановили: это не шло к делу. Для чего он был на дворе загоревшегося дома, на котором его видели свидетели? Он отвечал, что шел посмотреть, что делалось в Москве. Его опять остановили: у него не спрашивали, куда он шел, а для чего он находился подле пожара? Кто он? повторили ему первый вопрос, на который он сказал, что не хочет отвечать. Опять он отвечал, что не может сказать этого.

 Новогодние торты – оригинальные идеи оформления десертов в новогоднем стиле!
Новогодние торты – оригинальные идеи оформления десертов в новогоднем стиле! Толкование сна шнурки в сонниках Снилось белый шнурок
Толкование сна шнурки в сонниках Снилось белый шнурок Котенковские чтения Награды и звания
Котенковские чтения Награды и звания